Hey Dominik,
deine Bilder Links funktionieren nicht. Also zumindest bei mir.
Leider bist Du nicht angemeldet und kannst daher dieses Forum nur eingeschränkt benutzen. Möchtest Du die volle Vielfalt unserer Community erleben, so registriere Dich jetzt kostenlos & unverbindlich oder melde dich mit Deinen Benutzerdaten an.
Hey Dominik,
deine Bilder Links funktionieren nicht. Also zumindest bei mir.
Ists schon sehr warm bei dir?
Dinos die keine Symbionten sind und nicht in Korallen vorhanden sind, haben wir auch zu 99,9% nicht im Becken.
Sagt wer? Zooxanthellen sind meistens Symbiodinium, und die sind kugelförmig im Gegensatz zu P. lima (oder wahlweise O. ovata), die so aussehen wie das, was sich unter dem Mikroskop darstellt.
Hier ein interessanter Austausch dazu auf einem anderen Forum: https://www.meerwasserforum.in…fung-von-Dinoflagellaten/
Ich werde bei unserem nächsten Besuch mal den Großonkel meines Mannes um Artbestimmung zu bitten, der ist Professor für Phykologie. Der kann mir dann hoffentlich ein bißchen was dazu erzählen. Anrufen will ich ihn eigentlich nicht schon wieder, obwohl er sich gefreut hat, als ich ihn das letzte Mal ganz aufgeregt über Kieselalgen gelöchert habe. ![]()
deine Bilder Links funktionieren nicht. Also zumindest bei mir.
ist gefixt...
Also Dominik,
ich habe ja die Sirius X1, das ist zur Hybrid natürlich ein Unterschied. Trotzdem schreibe ich Dir jetzt mal wie ich es machen würde. Vielleicht hat der ein oder andere ja auch noch ne Idee dazu.
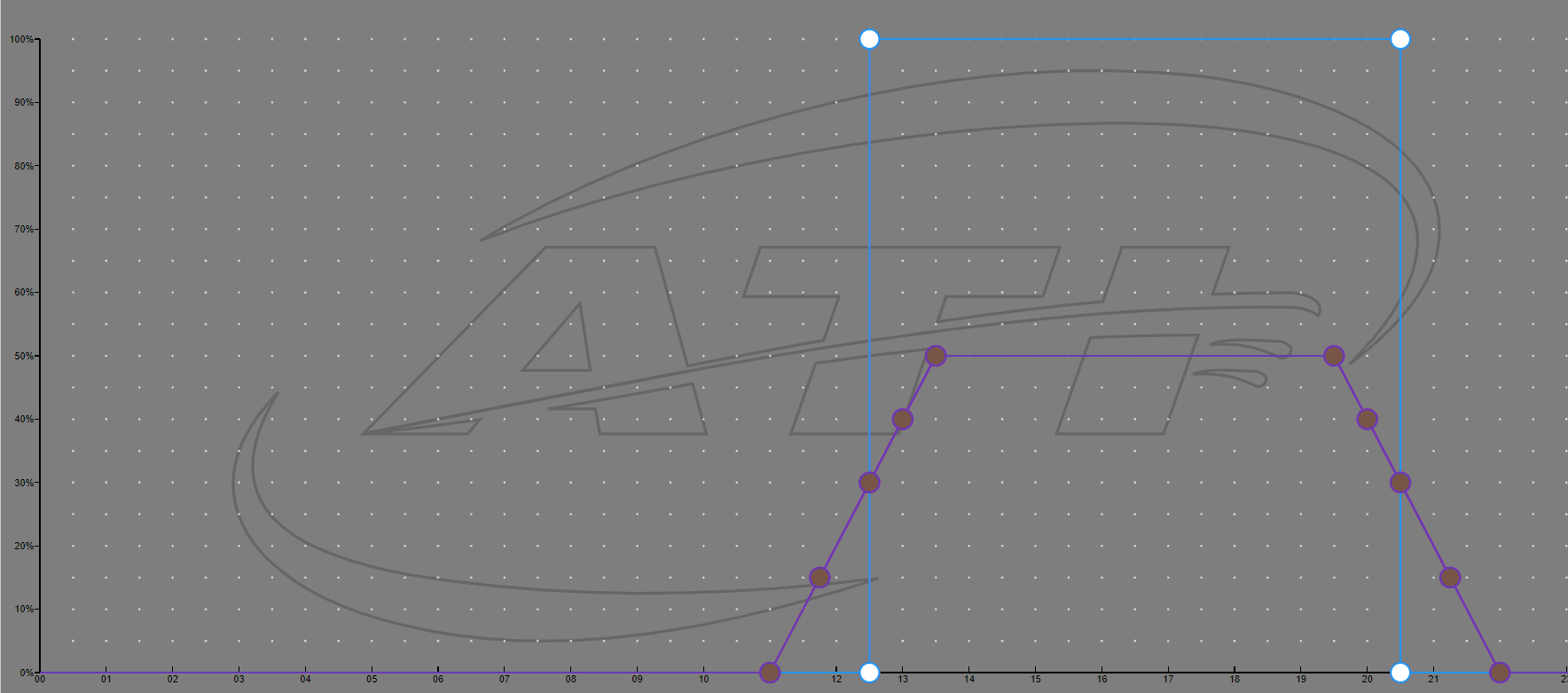
Ich denke in Deiner Einstellung ist der Strahlungsdruck durch die früh zugeschalteten T5 doch noch zu hoch. Der Höhepunkt der Lichtintensität sollte in der Mitte der Zeit das Maximimum aufweisen. Auch Dein LED Cycle geht zu früh hoch denke ich. Ich stelle Dir mal ein Bild von meinem aktuellen Cycle ein, da siehst Du das die Kurve nicht so schnell ansteigt. Mittlerweile bin ich wieder auf 11,5 Stunden da ich die Blauphasen wieder auf 30 Minuten habe. Bis jetzt kommt nichts nach.
Ich kenne mich mit der Hybrid nicht aus. Kannst Du das Maximum der T5 nicht in die Mitte der Zeit setzen? (gleichzeitig mit der LED im Maximum). Quasi wie ein Dreieck (jetzt ist es ein Viereck), also nach der Blaulichtphase ein progressiver Anstieg bis zum Peak und zurück.
Zusätzlich würde ich violett auf 5% nehmen, wie bei mir rot. Und ATI sagt bei der Sirius muss immer ein Wert voll auf 255 sein, egal ob weiß oder blau. Also würde ich Blau auf 255 stellen und gut ist.
Hier ein bisschen näher.
Ich habe vor 2 Tagen die Lampeneinstellungen nochmal überarbeitet... momentan laufen sie wie folgt:

Dass eine Farbe auf 255 gestellt werden muss, ist richtig. Steht so in der Bedienungsanleitung der ATI Hybrid.
Den Anstieg der LEDs auf 50% max. Tagesleistung habe ich meiner Meinung nach etwas entzerrt und die T5 starten erst, nachdem die LEDs schon 1.5 Stunden laufen. Seitdem ich diese Beleuchtungseinstellungen geändert habe, konnte ich auch kein Ausstoßen von Zooxanthellen mehr beobachten.
Ich werde diese Einstellung in den nächsten Wochen beibehalten und abwarten, ob diese eine Verbesserung bringen.
Werde morgen auch nochmal eine frische ICP abschicken...
Da ich mir mittlerweile selbst ein Mikroskop zugelegt habe, konnte ich feststellen, dass am Bodengrund überwiegend Dinos unterwegs sind und am Gestein eine Mischung aus Kieselalgen und Dinos, wobei die Kieselalgen mit einem geschätzten Anteil von 80% deutlich überwiegen.
Schönen Restsonntag euch!!
Dominik
Wird schon ![]()
Viel Erfolg!
Hmm? Du hast das Ausstoßen der Zooxanthellen beobachtet?
Wird ja immer spannender hier.
Ja, das habe ich tatsächlich. Zwei Euphys und eine Fungia haben immer wieder braune Fäden aus ihren Mundöffnungen gespuckt.
Ich vermute wirklich, dass mein „Problem“ die zeitweise Limitierung des Phosphats und der zusätzliche Strahlungsstress durch zu intensive Beleuchtung zum Abstoßen den Zooxanthellen geführt hat…
Hmm? Du hast das Ausstoßen der Zooxanthellen beobachtet?
Wird ja immer spannender hier.
Erklär mal bitte
Ich verweise jetzt mal auf die beiden Wikipedia-Artikel, einmal zu dem für den von mir als Ostreopsis ovata identifizierten Dinoflagellaten und einmal zu der als Zooxanthellen bekanntem Gattung Symbiodinium. Allein schon von der Größe her unterscheiden sich diese deutlich, und auch von der Form her. Falls sich freie Zooxanthellen im Aquarium befinden, habe ich sie zumindest nicht unter dem Mikroskop gesehen.
https://de.m.wikipedia.org/wiki/Ostreopsis_ovata
https://de.wikipedia.org/wiki/Symbiodinium
Das sind komplett unterschiedliche Arten, die auch gut zu unterscheiden sind. Eine davon sehe ich unter dem Mikroskop massenhaft, die andere gar nicht.
Und abgesehen davon will es mir nicht einleuchten, wieso es einem Endosymbionten eigentlich so gut außerhalb seines Wirtes gefallen sollte, dass es zu einer spontanen Massenvermehrung kommt.
Vielleicht erklärt mir das mal jemand in einer ruhigen Minute, oder verweist mich auf die entsprechende Fachliteratur.
Das schreibe ich alles nur noch der Vollständigkeit halber und bin dann jetzt auch raus hier und ihr könnt in Ruhe über eure Lampen reden.
Dominik, ich wünsche Dir, dass Du die Viecher bald los bist, und viel Spaß mit dem Mikroskop!
http://wetland.ihb.cas.cn/zgsd…020140926495708353435.pdf
Es gibt auf jeden Fall eine freilebende und eine sessile Form. Es ist also nicht abwägig wenn die von Korallen angestoßene Zooxanthenellen im freiwasser überleben und sich vermehren.
Danke für den Link. Ich habe nur den Abstract gelesen, aber der sagt eher das Gegenteil, nämlich dass die freilebenden Symbiodinium-Arten sich deutlich von den Symbionten unterscheiden, und dass es als unwahrscheinlich angesehen wird, dass die Korallen freilebende Symbiodinium-Arten aufnehmen.
Und ich betone nochmal: Es war unter dem Mikroskop kein Symbiodinium zu sehen. Wenn es welche wären, würde man sie sehen. Man sieht andere Dinoflagellaten. Wenn man eine Art sieht und die andere nicht muss man doch nicht diskutieren. Am Anfang waren wir uns noch alle einig, dass die braunen Beläge erst unter dem Mikroskop bestimmt werden müssen, bevor man rumdoktort. Jetzt hab ich es gemacht und es ist keinem recht.
Hey Dominik.
also wenn es jetzt darum ging den Strahlungsdruck zu verringern, werden deine neuen Einstellungen keinen wirklichen Effekt erzielen. Du bist immer noch nach 2,5 Stunden im Maximum, und zusätzlich feuert ja auch noch die T5.
Hast Du Dir mal die Sangokai Empfehlungen für Problembecken und Neueinrichtungen durchgelesen?
@ keksi
Most recently, increasing reports documented that Symbiodinium spp. could live outside their hosts (referred to as ‘free-living’) in the water column, benthic sands, macroalgal beds and fish faeces. Such free-living Symbiodinium spp. could be reservoirs for cnidarian hosts, and may be of particular importance if symbionts are lost during periods of stress (Carlos et al. 1999; Gou et al. 2003; Coffroth et al. 2006; Hirose et al. 2008; Manning & Gates 2008; Porto et al. 2008; Pochon et al. 2010; Takabayashi et al. 2011).
Der link war eher als Beantwortung zu deiner Frage gedacht wie Symbionten außerhalb der Symbiose überleben können. Das geht nur, wenn die Symbiose fakultativ und nicht obligatorisch ist. Dabei dind beide Partner getrennt zu bewerten. Letztere trifft auf die Koralle zu, letztere auf die Zooxanthenellen
Btw: Mit welchem Bestimmungsschlüssel hast du Dinos in deinem Becken denn identifiziert?
Achja, dass es free living zooxanthenellen geben muss, gehört ja zum Kreislauf der Fortpflanzung der Korallen mit dazu. Denn woher sollen die jungen Korallenlarven ihren Symbiosenpartner sonst herbekommen. Wird ja nicht mit vererbt.
Hey Dominik.
also wenn es jetzt darum ging den Strahlungsdruck zu verringern, werden deine neuen Einstellungen keinen wirklichen Effekt erzielen. Du bist immer noch nach 2,5 Stunden im Maximum, und zusätzlich feuert ja auch noch die T5.
Hast Du Dir mal die Sangokai Empfehlungen für Problembecken und Neueinrichtungen durchgelesen?
Die T5 ist dabei ja nicht das Problem, sondern eher die LED die zu scharf liefen.
Da darf die LED jetzt ruhig längere Zeit im Maximum laufen, solange das Maximum nur 50% o.Ä. ist.
Btw: Mit welchem Bestimmungsschlüssel hast du Dinos in deinem Becken denn identifiziert?
http://species-identification.…en&id=74&tab=beschrijving
Symbiodinium sind kugelförmig und zwischen 6 bis 13 µm groß (Wikipedia), Ostreopsis sind "tropfenförmig, oval und bauchseitig verschmälert" (Wikipedia) und fünfmal so groß. Und selbst, wenn es keine O. ovata sind, sage ich mit absoluter, hundertprozentiger und unumstößlicher Überzeugung, dass es keine Symbiodinium sind. Weder stimmt die Größe noch sind die Dinger kugelförmig. Und zumindest meine Korallen sind auch nicht ausgebleicht.
Wenn Du es selbst versuchen möchtest stelle ich Dir meine Fotos und Videos oder auch eine Wasserprobe gerne zur Verfügung. Ansonsten warte ich mal, was der bereits erwähnte Großonkel dazu sagt.
Der link war eher als Beantwortung zu deiner Frage gedacht wie Symbionten außerhalb der Symbiose überleben können.
Meine Frage war nicht, ob sie außerhalb der Symbiose überleben können. Dass ausgestoßene Endosymbionten oder Mastigoten (wieder) in Korallen aufgenommen werden können bestreitet keiner, und dass sie sich dann logischerweise vorher im Wasser befunden haben müssen ist auch klar. Dass sie sich dort aber pudelwohl fühlen und stark vermehren oder gar eine braune Pest auslösen bezweifele ich aber. Hier eine Arbeit darüber, dass ausgestoßene Endosymbionten außerhalb ihrer Wirtskoralle nicht lange überleben: https://espace.library.uq.edu.au/view/UQ:361966
Von explosionsartigem Populationswachstum ist da nicht die Rede.
@ keksi
Most recently, increasing reports documented that Symbiodinium spp. could live outside their hosts (referred to as ‘free-living’) in the water column, benthic sands, macroalgal beds and fish faeces. Such free-living Symbiodinium spp. could be reservoirs for cnidarian hosts, and may be of particular importance if symbionts are lost during periods of stress (Carlos et al. 1999; Gou et al. 2003; Coffroth et al. 2006; Hirose et al. 2008; Manning & Gates 2008; Porto et al. 2008; Pochon et al. 2010; Takabayashi et al. 2011)."
Die Studie kommt aber zu einem anderen Ergebnis. In der Discussion steht im Absatz "Comparison of endosymbiotic and free-living Symbiodinium [...]":
"None of the 218 sequences obtained from our environmental survey of free-living Symbiodinium matched those of the endosymbionts in neighbouring reef-building corals. This result is consistent with Pochon et al. (2010), who found that cp23S-HVR sequence types from the free-living Symbiodinium in water was distinct from those of dominant symbiotic algae in neighbouring reef corals."
"Furthermore, in most adult corals, the symbiosis is extremely specific and stable over time, although exogenous symbionts may be temporarily acquired under environmental stress (Goulet 2006; Sampayo et al. 2008; Thornhill et al. 2009; Coffroth et al. 2010). "
"All available evidence indicates that the pools of free-living Symbiodinium are entirely different in composition compared to the in hospite pool and this has significant implications in terms of acquisition, success and specificity"
Und dass die Symbiose mit freilebenden Symbiodinium instabil war, wenn sie denn zustande kam.
etc. pp.
Kann ja jeder selbst lesen.
Das mag für dich bei uns im Aquarium explosionsartig vorkommen, für ozeanische Verhältnisse ist das völlig normal. Da gibt es eben auch Stellen mit Cyanos oder Dinos. Zudem ist die Nährstoffkonzentration bei uns im Becken noch noch anders, was ein Wachstum begünstigen könnte. Und vlt mag es für dein Becken die seltene Form so sein, das sagt aber nichts über die generelle Häufigkeit in den Heimaquarien aus. Zudem hier in diesem Thread nicht mal um dein Becken geht. Deswegen empfinde ich diese Diskussion hier als rein akademischer Natur. Dominik hat ein konkretes Problem und hat nach konkrete Hilfestellung erbeten. So sehen seine Wasserwerte aus und damit muss man jetzt arbeiten.
Btw: eine Artbestimmung nur über eine kurze Beschreibung von Wikipedia durchzuführen, halte ich doch sehr als gewagt. Mein Grundstudium ist durchaus ein bisschen länger her, aber ich kann mich noch gut erinnern, wie man stundenlang an Mikroskopen mit Bestimmungsbüchern irgendwelches Gevieh bestimmen mussten. Und da reden wir von makroskopisch gut erkennbare und gut abgrenzbare morphologische Strukturen. Be Mikroben ist das doch äußerst schwierig, und klappt bestenfalls nur bis zur Familie, sodass man in den meisten Fällen nicht um eine Sequenzierung herumkommt, um die exakte Art bestimmen zu können, was in der Praxis auch eine gängige Methode ist.
Du hast noch kein Benutzerkonto auf unserer Seite? Registriere dich kostenlos und nimm an unserer Community teil!